|
"Хвойные бореальной зоны" 2009г., №1, с.
58-61
Культивирование in vitro, идентификация и биохимический состав некоторых видов Homobasidiomycetidae, образующих эктомикоризу с хвойными
Вайшля О.Б.,Ведерникова А.А.
Томский государственный университет
634050 Томск, пр. Ленина, 36; e-mail: planta@mail.tomsknet.ru
Изучены некоторые виды родов Amanita, Boletus, Cortinarius, Suillus, Tricholoma. Проведено выделение в чистую культуру, идентификация по макро- и микропризнакам, последовательностям 5,8S р-ДНК, исследованы особенности роста и биохимического состава при культивировании in vitro.
Ключевые слова: Homobasidiomycetidae, эктомикориза, культивирование invitro
Genuses of Amanita, Boletus, Cortinarius, Suillus, Tricholoma were studied. Cultures from fruit body, identification by macro-, micromorphological characteristics and DNA sequences were obtained. Peculiarities of growth, biochemical composition of cultures were analyzed.
Key words: Homobasidiomycetidae, ectomycorrhiza, in vitro culture
Введение
Интерес к феномену симбиоза корней растений с грибами-макромицетами не угасает с описания Франком в 1885 году практически всех типов EcM – эктомикориз (Roman et al., 2005; Agerer, 2008). Известно, что 8000 видов высших растений и 7000-10000 видов грибов планеты образуют EcM, которая рассматривается как реципрокный мутуализм/паразитизм, зависящий от генетических и экологических факторов (Tedersoo, 2007). Обязательная микотрофность хвойных как основных лесообразующих пород фитоценозов бореальной зоны обусловлена участием эктомикоризных грибов в круговороте биогенных элементов, а также способностью EcM оптимизировать метаболизм растений, усиливать минеральное питание и устойчивость к засухе, засолению, тяжелым металлам, патогенам (Smith and Read, 1997). В случае мутуалистических отношений EcM-грибы получают от растений 10- 50 % органического углерода и становятся конкурентноспособными в почве, а растения имеют возможность пользоваться коммуникационной подземной сетью из мицелия EcM-грибов и корневых систем разных видов деревьев, по которой передвигаются различные метаболиты, вода, источники энергии, кофакторы, витамины, гормоны, антибиотики, токсины и, возможно, генетическая информация.
Изучение экологии и физиологии EсM сосредоточено в основном в Европе, Северной Америке и Австралии (Smith and Read, 1997). В России различными аспектами EсM занимались многие исследователи: Возняковская Ю.М., Худяков Я.П., Шубин В.И., Чумак Н.Ф., Ахромейко А.И., Лобанов Н.В., Гельцер Ф.Ю., Ванин С.И., Зерова М.Я.,
____________________
*Работа поддержана грантом № 10-2006 конкурса технологических инновационных проектов по приоритетным направлениям экономики Томской области
Селиванов И.А., Еропкин К.И., Шемаханова Н.М., Красовская И.В., Частухин В.Я., Катенин В.Е., Саляев Р.К., Иванова Р.Н., Коротков Г.П., Семенова Л.А., Мишустин Е.Н., Пушкинская О.И., Каратыгин И.В. и другие. В настоящее время те или иные аспекты EсM изучают Шубин В.И. - в Карелии, Коваленко А.Е., Иванов Д.М. - в Санкт-Петербурге, Воронина Е.Ю. – в Москве, Творожникова Т.А. – в Сыктывкаре, Веселкин Д.В. – в Екатеринбурге, Шкараба Е.М. и Бойко Т.А. – в Перми. Насколько нам известно, на территории Сибири различные виды EсM хвойных изучает только Д.В. Веселкин, а также эстонские ученые - но EcM, образуемую грибами рода Tomentella (Koljalg, 1996). Целью нашей работы являлось введение в культуру Amanitamuscaria (L.: Fr) Hook; Amanitapantherina(Fr.) Secr.; Amanitaporphyria(Alb. & Schw. ex Fr.); Boletus betulicola (Vasil’kov) Pilat & Dermek; Boletus pinophyllus (Pilat & Dermek); Cortinarius caninus (Fr.) Fr.; Suillus bovinus (Linnaeus: Fr.) O. Kuntze; Suillus luteus (Fries) S. F. Gray, Nat.; Suillus sibiricus (Singer) Singer; Suillus variegatus (Sw.) Kuntze; Tricholomaportentosum (Fr.) Quel, изучение особенностей роста, молекулярная идентификация и определение содержания глюкозы, белка, фитогормонов и флавоноидов в культуральной жидкости.
Культивирование in vitro. Плодовые тела EcM-грибов собирали в бруснично-лишайниковых, зеленомошно-лишайниковых, зеленомошных сосняках правобережной части реки Обь в Томской области. Определение было проведено Н.Н. Агафоновой, исходные штаммы хранятся в коллекционном фонде «Mycota» Томского университета. Для получения изолята плодовое тело надрезали в нижней части ножки вдоль волокон прокаленным скальпелем и затем расщепляли в направлении разреза вместе со шляпкой. Из участка перехода ножки в шляпку вырезали кусочки трамы длиной несколько миллиметров и помещали на агаризованную питательную среду, разлитую косым слоем в пробирки. Через 14 суток культивирования при +24 °С отбирали пробирки с растущим грибным мицелием без посторонней микрофлоры и выращивали биомассу, идентифицировали по видовым макро- и микропризнакам. Прописи сред культивирования, красителей приводятся в книге Kreisel (1987).
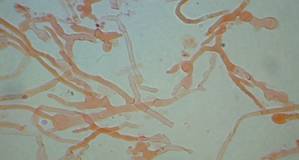
Идентификация. Из одной пробы каждого штамма засевали чашки Петри с разными видами сред в трех повторностях. Через 5 суток изучали макроморфологические характеристики (Hutchinson, 1991) – скорость роста, структуру и цвет колоний, пигментацию агара, запах; микроморфологические признаки – пряжки, морфологическую дифференциацию и толщину гиф (Рис. 1-А). Выделение и очистку ДНК проводили с помощью наборов «Quiagen» (Германия), ПЦР и секвенирование - по Von Clapp (1996). Для амплификации области ITS1-5.8S-ITS2 (Internal Transcribed Spacer) рибосомальной ДНК использовали общий для грибов праймер ITS1F (5’CTTGGTCATTTAGAGGAAGTAA 3’) и специфичный для базидиомицетов праймер ITS4B (5’TCCTCCGCTTATTGATATGC 3’). Полученные последовательности сравнивали с сиквенсами базы данных UNITE в программе BLAST.
Биохимический состав. Содержание белка в культуральной жидкости определяли с Кумасси-G250, глюкозы – с феррицианидом калия, флавоноидов – с AlCl3, фитогормоны – иммуноферментным методом с помощью наборов «Olchemim» (Чехия). Индивидуальные флавоноиды разделяли хроматографией на бумаге «FN-11» в системе растворителей бутанол:уксусная кислота:вода (4:1:2). Спектры флавоноидов прописывали на спектрофотометре «UV-1601 РС» (Shimadzu, Япония).
В данной публикации мы приводим результаты исследования некоторых культур. Все изученные виды хорошо росли на твердых питательных средах, однако, в зависимости от состава среды, характеристики роста различались. Так, при росте на средах BA, MEA, PDA Suillusbovinus образует белый высокий воздушный мицелий, гифы спутаны и растут во всех направлениях. Колонии бело-кремовые, с краями желтовато-белого цвета, по мере культивирования приобретающие розовато-кремовую окраску. На поверхности воздушного мицелия после месячного роста часто наблюдаются экссудаты в виде желто-коричневых капель. Выделяет в среду пигмент желто-коричневого или темно-коричневого цвета. Культура же Amanitapantherinaобразует на средах BA, MEA и PDA колонии, очень различающиеся по характеру роста и пигментации (рис. 1-Б). В жидкой культуре глубинное культивирование было возможным для Suillus(образуют шарики из гиф), у Amanita наблюдали только поверхностный рост. Динамику роста грибов в жидкой культуре изучали на среде «сусло-агар» и среде «Худякова-Возняковской», строя кривые роста по уменьшению содержания глюкозы и увеличению водорастворимого белка. Показана их обратная корреляция друг с другом.
В природных условиях визуально весьма затруднительно выяснить, какие именно виды грибов являются микоризообразующими для той или иной древесной породы. Мицелии разных видов EсM-грибов могут хорошо развиваться под землей и перекрываться, но при этом мицелий одного EсM-вида с помощью вторичных метаболитов может подавлять плодоношение других видов. Не всегда, даже часто посещая определенное место в лесу, можно застать момент плодоношения определенного вида гриба. Кроме того, известно, что около 50 % плодовых тел в лесных ценозах представлено таким массовым родом, как Cortinarius, однако только 5 % мицелия этих грибов обнаруживается в составе EcM. И наоборот, грибы рода Tomentella имеют крошечные плодовые тела, а в 60 % эктомикориз грибной компонент представлен мицелием именно этого рода.Не смотря на то, что, что грибы родов Cortinarius, Tricholoma, Suiluus образуют очень специфичную эктомикоризу, важно знать вид гриба–микоризообразователя для того или иного вида хвойного дерева. В качестве примера молекулярной идентификации EсM-грибов приводим сиквенс 5,8S р-ДНК длиной 695 нктд того образца Cortinarius, вид которого без ДНК-анализа определить было затруднительно, это оказался Cortinariuscaninus (рис.2). Сиквенс передан в Genbank NCBI, где ему присвоен номер депонирования 1041618.
а
|
 б б
|
Рисунок 1 – Изучение морфологических признаков Cortinariuscaninus (а) и особенностей роста Amanitapantherina на средах (б): сусло-агаре BA, мальтозном экстракте MEA, картофельно-декстрозном агаре PDA

|
TAGAGGAAGTAAAAGTCGTAACAAGGTTTCCGTAGGTGAACCT
GCGGAAGGATCATTATTGAAATAAACCTGATGGGTTGCTGCTG
GTTCTTTAATGAACATGTGCGCACTTGTCATCTTTATATCTCCA
CCTGTGCACCTTTTGTAGACCTGGACAAGTTTCTTAATGCTAGC
ATTGAGGTTTTGGGATTGACTTTGTCTCTCCTTATGTCTCCAGAT
CTATGTTTATTCATATACCCTAATGTATGTTATAGAATGTAATAA
AGTGGGCCTTTGTGCCTATAACACTATACAACTTTCAGCAACG
GATCTCTTGGCTCTCGCATCGATGAAGAACGCAGCGAAATGCG
TAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAATCTTTG
AACGCACCTTGCGCTCCTTGGTATTCCGAGGAGCATGCCTGTTT
GAGTGTCATTAATATATCAATCTCTTAAGCTTTTGCTTGTTGAGT
GTTGGATGTGGGGGCCTTTTTGCTGGTCTTTTAAAAGAGATCAG
CTCCCCTAAAATGTATTAGCGGAACATTTTGTTGACCGTTCATT
GGTGTGATAATTATCTACGCTATTGACGTGAGGCAGTTCAGCTT
CTAACAGTCCATTGACTTGGACAGTTTTTCATTAATGTGACCTC
AAATCAGGTAGGACTACCCGCTGAACTTAAGCATA |
а |
б |
Рисунок 2 – Некоторые этапы молекулярной идентификации Cortinariuscaninus: а - проверка чистоты амплифицированного методом ПЦР участка ITS1-5.8S-ITS2 р-ДНК; б – идентификация полученной последовательности в международном банке данных
Последовательности 5,8S р-ДНК и плодового тела, и культуры оказались идентичны, что свидетельствует о чистоте полученной культуры Cortinarius caninus. Для Suillus bovinus таким же образом была подтверждена идентичность плодового тела, полученной из него культуры и мицелия гриба из EcM, образованной после микоризации данным штаммом стерильных сеянцев сосны горной Pinusmontana.
В дополнение к классическим анатомо-морфологическим описаниям EcM-грибов очень ценными являются биохимические характеристики чистых культур, хотя это искусственное и стрессовое состояние для грибов-микоризообразователей. Растительные флавоноиды и гормоны вовлечены в самые разнообразные растительно-микробные взаимоотношения, в частности, в очень низких концентрациях рутин и зеатин индуцируют ветвление и рост гиф эктомикоризных грибов (Tagu, 2002). Грибные гифы также могут продуцировать ризосферные сигналы ауксиновой природы, например, ИУК - морфогенетический сигнал для увеличения скорости роста корешков и образования новых меристем для молодых боковых корней, которые и колонизирует гриб. Биологически активные вещества были измерены в середине log-фазы кривой роста. В 10- дневной культуре Suillussibiricus на среде Худякова-Возняковской мы обнаружили три индивидуальных цитокинина, ИУК и, к нашему удивлению, флавоноиды (табл. 1). В среде Худякова-Возняковской фитогормоны отсутствовали. Интересно отметить, что большая часть флавоноидов культур, судя по цвету пятен в ультрафиолете, относится к классу агликонов. Например, в культуре Amanita pantherina обнаружено 2 агликона с rf=0,53 и rf=0,85, спиртовый экстракт последнего имеет 3 максимума в спектре поглощения: 244 нм, 258 нм и 281 нм.
Таблица 1 – Содержание фитогормонов и флавоноидов в 10-дневной культуре Suillussibiricus
Трансзеатинрибозид,
фМ |
Изопентениладенозин,
фМ |
Дигидрозеатинрибозид,
пМ |
Индолилуксусная кислота,
фМ |
Сумма флавонодов, мкг/мл |
18±1,3 |
267±12 |
21±1,5 |
35±1,7 |
52±2,9 |
Поскольку в культурах всех штаммов уровни гормонов и флавоноидов различались – и между видами, и в пределах одного вида, вероятно, это отражает биохимическую стратегию образования микориз с конкретным типом хозяина – подобно тому, как это происходит в случае других растительно-микробных взаимоотношений, таких как Rhizobium или эндомикориза (Zeppa et al., 2005).
Изученные морфологические и биохимические особенности введенных нами в культуру эктомикоризообразующих грибов позволили оформить паспорт того или иного штамма, необходимый для регистрации в коллекции, и депонировать их под номерами: Suillus sibiricus (6) – LE (BIN) 2178; Cortinarius variicolor (14) – LE (BIN) 2179; Suillus luteus (34) – LE (BIN) 2180; Suillus bovines (38) – LE (BIN) 2181; Amanita porphyria (69) – LE (BIN) 2182; Amanita pantherina (70) – LE (BIN) 2183.
Авторы выражают глубочайшую признательность куратору коллекции культур базидиомицетов Ботанического института им. В.П. Комарова РАН Н.В. Псурцевой за помощь в освоении методик культивирования и за депонирование изученных культур.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Agerer, R. (ed.). Colour Atlas of Ectomycorrhizae. Einhorn-Verlag, Schwabisch Gmund. - 1996-2008. - V. I – VI.
Hutchinson L.J. Description and identification of cultures of ectomycorrhizal fungi found in North America // Mycotaxon, 1991. – V.XLII. – P.387-504.
Koljalg Urmas. Tomentella (Basidiomycota) and related genera in Temperate Eurasia / Oslo. – Fugiflora. – 1996. – 213 p.
Kreisel H., Schauer F. Methoden des mycologischen Laboratoriums / 1.Aufl. – Jena:Gustav Fisher Verl. - 1987. – 181 S.
Roman M., Claveria V., Miguel M. A revision of the descriptions of ectomycorrhizas published since 1961 // Mycology research. The British Mycological Society. UK, 2005. - T.109 (10). - P. 1063 – 1104.
Smith S.E., Read D.J. Mycorrhizal Symbiosis. - London: Academic Press Limited. - 1997. – 514p.
Tagu D., Lapeyrie F., Martin F. The ectomycorrhizal symbiosis: genetics and development // Plant and Soil, 2002.-V.244 - P.97-105.
Tedersoo Leho. Ectomycorrhizal fungi: diversity and community structure in Estonia, Seyshelles and Australia / Dissertationes Biologicae Universitatis Tartuensis.- Tartu Ulikooli Kirjastus.- 2007.– 54 р.
Von J.P. Clapp. Species diagnostics protocols / Humana Press. - Veroffentlicht. - 1996. – 416 S.
S. Zeppa, D. Sisti, R. Pierleoni, L. Potenza, M. Guescini, L. Vallorani, V. Stocchi. Tilia platyphyllos Scop.–Tuber brumaleVittad. vs. T. platyphyllos Scop.–T. borchiiVittad. ectomycorrhizal systems: a comparison of structural and functional traits // Plant Physiology and Biochemistry. 2005. № 43. Р. 709–716.
____________________
Поступила в редакцию 28 января 2009 г.
Принята к печати 13 марта 2009 г. |




