|
"Хвойные бореальной зоны" 2008г.,№3-4, с.
333-336
Регенерация Juniperus sibirica В. in vitro
Аёшина Е.Н., Величко Н.А.
ГОУ ВПО «Сибирский государственный технологический университет»
660049 Красноярск, пр. Мира, 82
На основании проведенных исследований и анализа литературных данных были определены условия для введения в культуру invitro JuniperussibiricaB. и разработаны основные этапы его микроклонального размножения, обеспечивающие получение элитного посадочного материала.
Ключевые слова: культивирование, хвойные породы, среды, регуляторы роста, почки, микроклональное размножение, органогенез, ризогенез, адаптации
On the basis of the carried out researches and analysis of the literary data the conditions for introduction in culture in vitro Juniperus sibirica B. were determined and the basic stages it microclonal of duplication ensuring reception elited of a landing material are developed.
Key words: cultivated, coniferous breeds, medium , regulators of growth, kidney, microclonale propagation, organogenese, rhizogenese, adaptation
Введение
Последние годы особый интерес для введения в культуру стали представлять хвойные породы, отличающиеся низким естественным возобновлением, содержащие ценные биологически активные вещества. Хвойные породы долгое время оставались редкими объектами исследования в культуре тканей, что было связано с трудностями их культивирования.
Метод культуры клеток и тканей хвойных получил значительное развитие в последние три десятилетия. Исследования хвойных пород сосредоточены вокруг видов, имеющих наиболее важное хозяйственное значение для данной страны или региона. Наиболее изученными в культуре in vitro являются такие виды, как ель обыкновенная (Piceaabies), сосна обыкновенная (Pinussilvestris) (Ingram, 2000; Wang, 1991; Байбурина,1998).
Метод культуры тканей все чаще стал использоваться в селекции хвойных при размножении и выращивании посадочного материала различных видов, отличающихся медленным ростом или трудностями при получении семенного материала. Технология микроклонального размножения по сравнению с традиционными методами вегетативного размножения имеет ряд следующих преимуществ: высокий коэффициент размножения; расширение сезонности выполняемых работ; возможность получения в большом количестве вегетативного потомства трудноразмножающихся в обычных условиях видов или видов, не способных к вегетативному размножению традиционными методами; ускорение перехода от ювенильной к репродуктивной фазе развития; возможность работать круглый год и планировать выпуск растений к определенному сроку (Thorpe,1988).
В мировой практике технология микроклонального размножения разработана более чем для 25 видов хвойных (Negussie,1997).
Можжевельники, как и многие другие хвойные виды, характеризуются пониженной регенерационной способностью как в естественных условиях, так и в культуральной среде. В этой связи особый интерес представляют работы исследователей, направленные на создание технологии микроклонального размножения можжевельников.
Исследования по микроклональному размножению можжевельника высокого (Juniperusexcelsa) проводил Berha D. (Berha,1998). Им изучено влияние гормонов на адвентивное почкообразование. В качестве эксплантов использовали семядоли и зародыши. Экспланты были посажены на основные среды Eriksson (1965), Murashige and Skoog (1962), с содержанием 6-бензиламинопурина (6-БАП) 0,5-1,0 мг/л и ?-нафтилуксусной кислоты (?-НУК) 0,02 мг/л. Наиболее лучшей для раннего инициирования активного морфогенетического развития адвентивных почек при использовании в качестве эксплантов – семядолей оказалась питательная среда Eriksson с добавлением 0,5 мг/л 6-БАП и 0,02 мг/л ?-НУК. На данной среде было получено наибольшее количество (92) адвентивных побегов. Более высокая концентрация 6-БАП, особенно с высоким уровнем ?-НУК, подавляла образование адвентивных почек на семядолях. Процент адвентивных почек, которые производили семядоли, прогрессивно уменьшался с повышением концентрации ?-НУК при постоянной концентрации 6-БАП. Напротив, присутствие в базисной среде Murashige and Skoog 0,002 мг/л ?-НУК значительно подавляло образование адвентивных почек на семядолях. Наилучшие результаты по образованию адвентивных почек наблюдались на среде, содержащей только 6-БАП в концентрации 1 мг/л. При использовании в качестве эксплантов эмбрионов можжевельника, для получения адвентивных почек, наилучшей оказалась среда Murashige and Skoog, дополненная 1,0 мг/л 6-БАП и 0,02 мг/л ?-НУК (Berha,1998).
Одной из наиболее трудных задач при микроклональном размножении в культуре тканей является укоренение побегов и их успешная адаптация к условиям invivо. Для укоренения побегов Juniperusexcelsa использовали ?-индолилмасляную кислоту (?-ИМК) (1 мг/л) и ?-НУК (0,5 мг/л) Укоренение производили в поддонах, заполненных компостом. Растения прекрасно адаптировались к условиям invivо (Berha,1998).
Другие эфиопские исследователи проводили работы по укоренению можжевельника (Juniperusprosera) в песке, для этого использовали черенки от молодых и зрелых деревьев. Для укоренения также использовали четыре наиболее распространенные растительные гормоны индолил-3-уксусную кислоту (ИУК), ?-ИМК, ?-НУК и 2,4 Д. Побеги погружали в растворы с различными концентрациями гормонов на 24 часа, после чего помещали в емкости с песком и ставили в теплицу. Максимальный процент укоренения (24 %) был получен при обработке молодых черенков ИУК 10-7 М (0,0175 мг/л). Процент укореняющихся растений уменьшался при обработке черенков более низкой концентрацией ИУК (10-6 М), при этом они имели более разветвленную корневую систему. Обработка черенков ?-НУК (10-3 М) стимулировала образование более длинных корней (Leopold, 1975).
Авторами был сделан вывод, что наиболее важным фактором в укоренении можжевельника (Juniperusprocera) является возраст растений. Всего 24% всех черенков, полученных от молодых растений, были способны укорениться, черенки от зрелых растений укоренялись хуже (Leopold,1975). Это может быть следствием уменьшения уровня ауксина в зрелых растениях (White,1984), лигнифицирования тканей, которое ведет к замедлению морфологических процессов или предотвращению в целом (White,1984), присутствия большого количества камеди, приводящее к уменьшению количества паренхиматозных тканей (Zajczkowski, 1973), уменьшения подвижности введенных веществ в зрелых тканях (Hortmann, 1990), повышения с возрастом синтеза корневого ингибитора (Leakey,1992), физиологического старения (Mesen, 1997).
Кроме того, Mesen установил, что укоренение черенков связано с фотосинтетической деятельностью. Leakey (Mesen, 1997) подчеркнул, что на укоренение черенков влияет окружающая среда, ареал произрастания, физические факторы и концентрация гормонов.
Можжевельник сибирский является уникальным видом, представляющим интерес для озеленения и получения ценных биологически активных веществ. Но традиционные способы восстановления можжевельника сибирского не являются достаточно эффективными и требуют совершенствования. В связи с этим разработка эффективных методов массового размножения можжевельника сибирского является достаточно актуальной проблемой.
В результате проведенных исследований нами был разработан метод клонального микроразмножения Juniperussibirica В. в условияхinvitro.
Методическая часть
Первым шагом в микроклональном размножении является разработка методов индуцированного органогенеза. Обязательным условием для микроклонального размножения является использование объектов, полностью сохраняющих генетическую стабильность. Этому условию удовлетворяют пазушные почки органов стеблевого происхождения. Поэтому в качестве исходного материала для получения изолированных культур были выбраны вершины побегов размером 15-20 мм.
На начальном этапе исследования важно было подобрать оптимальные условия для стерилизации эксплантовJuniperussibirica В. В результате эксперимента было установлено, что наиболее эффективным стерилизующим раствором оказался 0,1%-й раствор диацида с добавлением твина-80 (1-2 капли на 1 л) при продолжительности экспозиции эксплантов можжевельника сибирского в течение 25 мин. Эффективность стерилизации при этих условиях составила 97,50 %. При проведении дальнейших экспериментов использовали эти условия стерилизации.
Одним из способов регуляции органогенеза в культуре органов и тканей являлось использование питательных сред с добавлением цитокининов и ауксинов (Гамбург, 1983; Гамбург, 1990).
Как показал анализ литературных данных, для введения в культуру можжевельника чаще всего используются питательные среды с минеральной основой по Murashige and Skoog 1962 (MS), Schenk and Hildebrandt 1972 (SH), Eriksson 1965 (ER). В данной работе были использованы среды с минеральной основой по MS, SH, Uata, Кnop и Sierlis (Бутенко, 1977).
Экспериментальная часть
Стерильные однолетние побеги Juniperussibirica В. вводили на агаризованные питательные среды с минеральным составом по Murashige and Skoog, Schenk and Hildebrandt, Uata, Кnop и Sierlis без добавления гормонов. Всего на этом этапе было отобрано и введено в культуру invitrono 50 эксплантов на каждую среду (всего изначально было введено в культуру 300 эксплантов). Полученные результаты относительно выживаемости эксплантов приведены в таблице 1.
Из полученных результатов следует, что наиболее благоприятной для культивирования эксплантов оказалась питательная среда, содержащая минеральные соли по Murashige and Skoog (МS) с добавлением 30 г/л сахарозы и витаминов: пиридоксина (В6), тиамина хлорида, ниацина в количестве по 1 мг/л (рис. 2, а).
Следующим важным моментом в процессе микроклонального размножения было подавление апикального доминирования у эксплантов Juniperussibirica В. и стимуляция роста пазушных почек. Для достижения этой цели вводили в питательную среду гормоны ауксинового и цитокининового типа (рис. 1) .
Таблица 1 - Влияние минерального состава питательных сред на жизнеспособность и качественные характеристики растений в условиях invitro
Название среды |
Количество жизнеспособных растений, % |
Качественная характеристика растений |
Murashige and Skoog |
93,30 |
состояние отличное, зеленые, наблюдается рост |
Schenk and Hildebrandt |
86,60 |
состояние хорошее, зеленые, рост не наблюдается |
Uayta |
76,60 |
состояние хорошее, зеленые, рост не наблюдается |
Кnop |
36,60 |
состояние удовлетворительное, бледно-зеленые, рост не наблюдается |
Sierlis |
90,00 |
состояние отличное, зеленые, наблюдается рост |
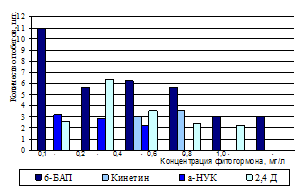
Рисунок 1 - Влияние концентрации и вида гормонов в среде на инициацию побегов Juniperussibirica В.
На всех средах с содержанием 6-БАП в концентрации от 0,1-1,0 мг/л происходила стимуляция роста пазушных почек. В зависимости от концентрации гормона 6-БАП в среде развитие пазушных почек происходило либо у основания экспланта, либо по всему экспланту. Наибольшее количество побегов было получено на среде с макро- и микро
элементами по MS с добавлением 0,1 мг/л 6-БАП (рис. 2, б).
На следующем этапе полученные микропобеги в стерильном боксе отделяли скальпелем от экспланта и помещали на свежую питательную среду. Для выращивания побегов в среду MS были добавлены регуляторы роста в различных концентрациях и сочетаниях. Наибольший прирост побегов (1,8 см) в высоту наблюдался на питательной среде с содержанием ?-НУК (0,1 мг/л) и 6-БАП (0,5 мг/л) (рис.2, в).
В работе по стимуляции ризогенеза у побеговJ. sibirica В. варьировали концентрацией гормонов и составом питательных сред. Ризогенез наблюдали на побегах J. sibirica В., культивируемых сначала на среде Uata с добавлением ИУК (0,05 мг/л) в течение месяца, затем на среде МS/2 в течение трех месяцев. Появление первых корней на эксплантах J. sibirica В. отмечали к концу 15-й недели (рис. 2, д). Образование корней происходило на безэпитальной части побега. Максимально достигнутый процент укоренения побегов J. sibiricaсоставил 17,50 % .

Рисунок 2 - Этапы микроклонального размножения Juniperussibirica В.
Процесс адаптации пробирочных растений к почвенным условиям является сложной операцией. Поэтому при пересадке растений-регенерантов были созданы условия, идентичные с их развитием в условиях invitro.
Экспланты осторожно вынимали из пробирок, корневую систему побегов отмывали от агара дистиллированной водой и помещали в горшочки для рассады на 1/3 заполненые торфо-перлитной смесью в соотношении 1: 2. Горшочки с растениями помещали в теплицу с температурным режимом - (22±1 0С) и относительной влажностью 60 %. Для лучшей адаптации растений горшочки с растениями были накрыты полиэтиленовыми изоляторами, которые постепенно открывали до полной адаптации растений. Количество адаптированных растений к условиям invivo составило 91,60 %. Весной полученные саженцы были высажены в открытый грунт.
Заключение
Таким образом, в результате проведенного эксперимента были определены условия для введения в культуру invitro JuniperussibiricaB. и разработаны основные этапы его микроклонального размножения.
Библиографический список
Байбурина, Р.К. Микроклональное размножение взрослых гибридных деревьев BetulaPendula roth var. carelica merckl / Р.К. Байбурина // Раст. ресурсы. – 1998. – Т. 34. -№ 2. – С. 9-22.
Бутенко, Р.Г. Рост и дифференциация в культуре клеток растений / Р.Г. Бутенко // Рост растений и природные регуляторы. – М. : Наука, 1977. – С. 697-710.
Гамбург, К.З. Ауксины в культурах тканей и клеток растений [Текст] / К.З. Гамбург, Н.И. Рекославская, С.Г. Швецов. – Новосибирск : Наука, 1990. – 243 с.
Гамбург, К.З. Фитогормоны и клетки [Текст] / К.З.Гамбург. – М. : Наука, 1970. – 102 с.
Berha, D. Asexual propagation of Juniperus procera from Ethiopia: a contribution to the conservation of African pencil cedar / D. Berha, L. Negash // Forest Ecology and Management. – 1998. – Vol. 112. – P.179-190.
Hortmann, H.T. Plant cell / H. T. Hortmann, D. E. Kester, F. T. Davies // Plant Propagation: Principles and Practices : 5th ed. Prentice-Hall, Englewood Cliffs. – New Jersey, 1990. – Р. 16-27.
Ingram, B. Effect of bioreactor configuration on the growth and maturation of Picea sitchensis somatic embryo cultures / B. Ingram, F. Mavituna // Plant. Cell. – 2000. – Vol. 61. – P. 87-96.
Leakey, R. R. B. Stockplantderived variation in rooting ability: the source of physiological youth / R.B. Leakey, J.Mc. P. Dick, A.C. Newton // Paper presented at the Symposium on Mass Production Technology for Genetically Improved Fast Growing Forest Tree Species, Bordeaux. – France, 1992. – P. 171-178.
Leopold, A.C. Plant Growth and Development / A.C. Leopold, P.E. Kriedemann. – 2 ed. – McGraw-Hill, 1975. – 545 p.
Mesen, J.F. The effects of propagation environment and foliar area on the rooting physiology of Cordia alliodora (Ruiz and Pavon) Oken cuttings / J.F. Mesen, A.C. Newton, R. R. B. Leakey // Trees. – 1997. – № 11. – P. 404-411.
Negussie, F. In vitro induction of multiple bads in tissue culture of Juniperus excelsa / F. Negussie // Forest Ecology and Management. – 1997. – Vol. 98. – P. 115-123.
Thorpe, T.A. Micropropagation in conifers: methods, opportunities and costs / T. A. Thorpe, S. Hasnain // Prec. 21. Meet Can Tree Improv. Assoc ''Tree improvement – progressing together'', Truro NS 1987, Can. For. Serv., Chalk River. – Chalk River, 1988. – P. 68-84.
Wang, K.X. Adventitious bus production from mature Picea abies: rejuvenation associated with female strobili formation / K.X. Wang, D.F. Karnosky, R.Timmis // Woody Plant Biotechnology. – 1991. – P. 83-90.
White, J. Factor influencing adventitious root production in cuttings of Griselinia littoralis and Griselinia lucida / J. White, P. H. Lovell // Ann. Bot. – 1984. – Vol. 53. – P. 443-446.
White, J. The anatomy of root initiation in cuttings of Griselinia littoralis and Griselinia lucida / J. White, P. H. Lovell // Ann. Bot. – 1984. – Vol. 54. – P. 7-20.
Zajczkowski, S. Auxin stimulation of cambial activity in Pinus silvestris. I. The differential cambial response / S. Zajczkowski // Physio. Plant. – 1973. – Vol. 29. – P. 281-287.
Поступила в редакцию 26 марта 2008 г.
Принята к печати 27 августа 2008 г. |




