|
"Хвойные бореальной зоны" 2007г.,№2-3, с.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ МЕТОДОВ БИОТЕХНОЛОГИИ ДЛЯ РАЗМНОЖЕНИЯ ГЕНЕТИЧЕСКИ ЦЕННЫХ ФОРМ ЛЕСНЫХ ДРЕВЕСНЫХ ВИДОВ
Третьякова И.Н., Белоруссова А.С., Носкова Н.Е., Савельев С.С., Лукина А.В., Барсукова А.В., Ижболдина М.В., Череповский Ю.А.
Институт леса им В.Н. Сукачева СО РАН, Красноярск, Россия
660036, Красноярск, Академгородок 50, ИЛСОРАН, т. (3912) 49-44-47 Факс (3912) 43-36-86 culture@ksc.krasn.ru
Инициация соматического эмбриогенеза у хвойных видов – лиственницы сибирской (Larixsibirica Ledeb.) и сосны сибирской (Pinussibirica Du Tour) проводилась с использованием зиготических зародышей на разных стадиях их развития и сегментов вегетативных побегов, андроклинии из микроспор и недозрелых мужских гаметофитов. Культивирование велось на среде MS и ? MS, ? LV и MSG, DCR и K99 с гормонами 2,4-Д, 6-БАП, ИМК и АБК в разных концентрациях. Успешность соматического эмбриогенеза и андроклинии у хвойных видов связана с генотипом дерева и зависит от стадии развития эксплантов.
Induction of somatic embryogenesis in Siberian coniferous species - Siberian larch (Larix sibirica Ledeb.) and Siberian pine (Pinus sibirica Du Tour) has been conducted from zygotic embryos on different stages and segments of vegetative shoots, androgenesis in vitro from microspores and immature male gametophytes. Culturing was made on MS, ? MS, ? LV, MSG, DCR and K99 nutrition media with hormones 2,4-D, 6-BAP, IBA and ABK in different concentrations. Success of somatic embryogenesis procedure of Siberian coniferous species connected with tree genotype and depends on stage of explants development
Введение
На основании свойства тотипотентности клеток в биотехнологии микроклонального размножения хвойных появилось два новых направления – соматический и микроспориальный эмбриогенез. Изучение соматического и микроспориального эмбриогенеза открывает большие перспективы в познании процесса клеточной дифференцировки и реализации морфогенетических программ в эмбриогенезе и раннем онтогенезе растительного организма, а также получении высокопродуктивных генетически однородных чистых линий. Соматический эмбриогенез был получен у 16 видов рода Pinus, у 11 видов рода Picea, у 4 видов и 2 гибридов рода Abies, у 6 видов и гибридов рода Larix, а также у Pseudotsuga menziesii [1]. В качестве источника соматических клеток для индукции соматического эмбриогенеза у хвойных использовались мегагаметофиты, зрелые и незрелые зародыши, семядоли, гипокотили, хвоя [2], и сегменты вегетативных побегов [3].
Несмотря на активные исследования в области соматического эмбриогенеза у хвойных, регенерация растений данным способом все еще остается проблематичной для большинства видов. Критическим моментом является процесс созревания соматических зародышей, поскольку он влияет на жизнеспособность полученных de novo зародышей, и особенно на их способность прорастать и продуцировать нормальные растения-регенеранты.
Изучение соматического эмбриогенеза у сибирских видов хвойных до сих пор не проводилось, а исследования по андроклинии у голосеменных вообще отсутствуют. Между тем, репродуктивный потенциал хвойных растений в Сибири за последние годы значительно снизился из-за техногенной нагрузки, изменения климата и интенсивной вырубки древостоев. Применение эффективных инновационных технологий, таких как соматический
эмбриогенез и андроклиния в сочетании с криоконсервацией и различными селекционными программами даст возможность для получения, раннего отбора и испытания ценных генотипов, их быстрого распространения, что будет способствовать массовому получению улучшенных высокопродуктивных клонов и чистых линий хвойных растений.
Цель настоящих исследований - в разработка биотехнологии получения соматических зародышей у хвойных видов Сибири и проведение цитоэмбриологического анализа полученных структур.
Материал и методы исследования
Объектом настоящих исследований являлись деревья лиственницы сибирской (LarixsibiricaLedeb.), произрастающие в естественных насаждениях на территории Республики Хакасия и Тыва, в искусственных насаждениях г. Красноярска. В работе использовали 32 генотипа лиственницы сибирской устойчивых (Днп1, Днп2, Днп3, Днп4, Днпу, Дбнп, Х47, Унп2, Унп3) и неустойчивых (Ап1, Дп-1, Дп2, Дбп1, Дбп2, Дбп3, Дб7, Дб12, ККп, Кп, Ду3, Кп1, К-п, Б10, Б11, Б14, Кп2, Дсп, Уп1, Уп2, Уп3, Уп4, Уп5) к поражению лиственничной почковой галлицей.
Деревья сосны сибирской (кедра сибирского – Pinussibirica Du Tour) произрастали в естественном древостое Западного Саяна (Ермаковский и Шушенский районы Красноярского края) и на клоновых прививочных плантациях Западно-Саянского опытного лесного хозяйства. Для взятия образцов использовалось 6 деревьев-доноров №: 1т, 2т. 8. 277/22. 704, 1А (естественный древостой) и 3 клона: 26, 28 и 22 (черенки взяты с дерева 277/22) – свободное опыление и 22хА – клон 22, опыленный пыльцой материнского гетерозисного дерева с однолетним развитием женских шишек №1А в 2005г.).
В качестве эксплантов использовались мегагаметофиты, незрелые зиготические зародыши, а также сегменты однолетних вегетативных побегов, микроспороциты, микроспоры и пыльца у лиственницы сибирской и сосны сибирской.
Для инициации эмбриональной массы из зиготических зародышей использовались базовые MS, ? MS, ? LV, MSG, DCR и K99 [4] с добавлением мезоинозита (0,1 г/л), L-глютамина (1,45 г/л), фитогормонов: 2,4-Д (2 мг/л) и 6-БАП,(1 мг/л), сахарозы (30 г/л), а также агара (7 г/л) или Gelrite (4 г/л) [5, 6]. Для пролиферации эмбриональной массы концентрация 6-БАП, 2.4-D и сахарозы снижалась в 2-4 раза (у разных видов по-разному). Эксперименты по индукции и пролиферации ЭСМ проводились в темноте при температуре 24 ± 1оС. Для перехода соматических зародышей к созреванию экспланты культивировались на безгормональных базовых средах c активированным углем (1 г/л) в течение 1 недели Для созревания соматических зародышей в среды добавлялись мезоинозит (0,1 г/л) L-глютамин (1,45 г/л), 2,4-Д (2 мг/л), АБК (5-15 мг/л), сахароза (30 г/л), а также агар (7 г/л). Культивирование проводилось на свету, при 16-часовом фотопериоде и температуре 24 ± 1оС.
Для индукции каллуса из сегментов вегетативных побегов проводилась обработка эксплантов низкой температурой (+2-3°С в течение трех дней) на средах DCR [3] и ? MS, содержащих 30 г/л сахарозы, 0,3 % активированного угля и 1,5 г/л Gelrite без гормонов. Для индукции каллусообразования проводился перенос эксплантов на базовые среды с добавлением 1 г/л L-глютамина, 1 г/л гидролизата казеина, 1 г/л мезоинозита, 30 г/л сахарозы и 1,5 г/л Gelrite, а также 2,4-Д (4,42 мг/л), 6-БАП (2 мг/л) и индолилуксусной кислоты (ИУК, 2-4,4 мг/л). Экспланты выдерживались в темноте, при температуре 24± 1°С. Пролиферация каллусных культур проводилась на средах DCR и ? MS, содержащих 40 г/л сахарозы, 0,44 мг/л 2,4-Д и 0,5 мг/л БАП, а также 2 г/л Gelrite (в темноте, при температуре 24±1оС).
Для индукции андроклинных культур у лиственницы сибирской экспланты вводились в культуру на протяжении зимы и ранней весны и не подвергались дополнительной предобработке, в то время как индукция андроклинии в весенний период, когда температура воздуха поднималась выше нуля, требовала дополнительной стрессовой обработки эксплантов низкими положительными температурами (2-3о С) в течение 1-3 сут.
Для индукции андроклинии экспланты помещались на твердые и жидкие базальные среды MS, ? MS, WPM и K99 [7], различающиеся по составу макроэлементов, витаминов и гормонов. В качестве желирующего компонента использовался агар в концентрации 6 г/л. pH среды до автоклавирования доводился до 5,7±0,1.
Для поддержания андроклинных культур лиственницы сибирской использовались базальные питательные среды К99, MS и ? MS с добавлением дополнительных компонентов. Культивирование проводилось на свету (16-часовой световой период), а также в темноте, при температуре 24±1о С.
Для проведения цитологического анализа использовались давленные препараты. Окраска эксплантов проводилась сафранином с добавлением капли метиленового синего [8].
Просмотр микроскопических образцов осуществлялся на микроскопе МБИ-6. Статистическая обработка данных проводилась по стандартным методикам при помощи Microsoft Excel. Морфологические изменения фиксировались цифровой фотокамерой Fudjifilm FinePix S7000 (Япония).
Результаты и обсуждение
Соматический эмбриогенез из зиготических зародышей лиственницы сибирской (Larixsibirica Ledeb.)
Влияние стадии развития экспланта на индукцию соматического эмбриогенеза у лиственницы сибирской. Выявлено, что образование эмбриогенного каллуса (ЭМ) и эмбриональной суспензорной массы (ЭСМ) у лиственницы сибирской зависит от стадии развития зиготических зародышей, вводимых в культуру invitro.
Наиболее перспективными при введении в культуру оказались незрелые зиготические зародыши, находящиеся на стадии позднего эмбриогенеза: зародыши на стадии инициации семядолей (II дек. июля) формировали ЭМ в 66,7 % случаев; зародыши, у которых семядоли полностью сформированы (III дек. июля), продуцировали ЭМ в 98 % случаев.
Культивирование зрелых зиготических зародышей лиственницы сибирской на среде MSGI индуцировало активный рост семядолей и формирование неэмбриогенного каллуса на гипокотиле у 30% зародышей. Заложение очагов эмбриогенного и неэмбриогенного каллуса на одном и том же экспланте происходило у 40 % зрелых зиготических зародышей. В дальнейшем отдельные участки ЭСМ продуцировали единичные соматические зародыши.
Пролиферация эмбриогенных культур лиственницы сибирской. Полученная ЭСМ в течение 7 мес. (сентябрь-март) поддерживалась на пролиферационной среде (MSGII). На протяжении всего срока культивирования происходил интенсивный прирост ЭМ и образование соматических зародышей.
Влияние состава питательной среды на формирование соматических зародышей лиственницы сибирской. Состав базовых сред не оказал заметного влияния на формирование ЭМ, тогда как введение L-глютамина в среду значительно стимулировало образование ЭСМ и развитие соматических зародышей.
- Культивирование эксплантов на базальной среде MS с L-глютамином приводило к формированию аномально развитых соматических зародышей, превышающих по размерам нормальные соматические зародыши в 2-3 раза. Они имели массивный суспензор (ширина 230,0 ± 0,6 мкм) и крупное тело зародыша (ширина 470,0 ± 2,5 мкм).
Культивирование зиготических зародышей на среде MSG, содержащей L-глютамин, приводило к нормальному развитию соматических зародышей, их строение было аналогичным строению зиготиче-
ских зародышей.
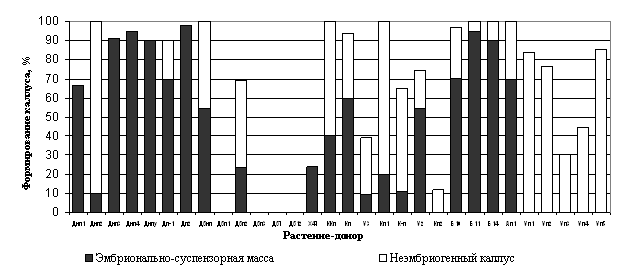
Влияние генотипа растения-донора на соматический эмбриогенез лиственницы сибирской. Из общего числа исследованных генотипов 13 % были не способны формировать каллус, 67 % генотипов формировали каллус неэмбриогеного типа (рисунок. 1). Лишь 20 % исследуемых генотипов были способны формировать ЭМ. Наиболее интенсивное формирование ЭСМ из зародышей, находящихся на стадии инициации семядолей на 7 сут., было отмечено у генотипа Дп2, наименьшее - у Ду3
Рисунок 1 - Способность к формированию эмбриогенного и неэмбриогенного каллуса у
исследованных генотипов лиственницы сибирской
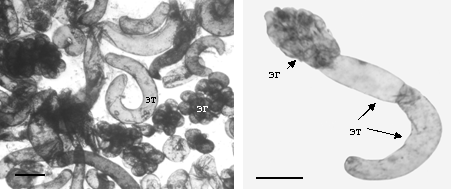
Рисунок 2 - Формирование кластеров эмбриональных клеток (эг - эмбриональные глобулы),
с примыкающими к ним эмбриональными трубками (эт). Масштаб 100 мкм
Цитоэмбриологическая характеристика протекания соматического эмбриогенеза у лиственницы сибирской. Процесс соматического эмбриогенеза у лиственницы сибирской начинался с формирования ЭСМ. На 5-е сут. культивирования клетки зародыша в области зародышевого корешка (периколюмна), длина которых составляла в среднем 62,5 ± 6,5 мкм, начинали интенсивно растягиваться и достигали в длину 193,3 ± 4,5 мкм и превращались в эмбриональные трубки. Эти клетки подвергались дальнейшему растяжению и неравному делению, в результате которого на одном из полюсов формировались небольшие эмбриогенные клетки диаметром 39,2 ± 1,2 мкм. В течение следующих 5-7 сут. клетки эмбриональных инициалей продолжали делиться и образовывали кластеры эмбриональных клеток (эмбриональные глобулы), к которым примыкала эмбриональная трубка (рисунок 2). Клетки эмбриональных трубок также продолжали делиться и формировали дополнительные эмбриональные трубки и эмбриональные инициали.
Перенос эксплантов через 1 мес. на среду с пониженным содержанием цитокининов и сахарозы (MSGII) вызывал активную пролиферацию ЭСМ,
выражавшуюся в увеличении размеров эмбриональных глобул и числа эмбриональных трубок. На 1 мм3 ЭМ насчитывалось до 75,0 ± 4,6 эмбриональных глобул. Через 1 мес. культивирования на среде MSGII из ЭСМ возникали соматические зародыши.
Через 1 мес. культивирования на среде MSGIV, содержащей АБК соматические зародыши приобретали четкую биполярную структуру: на одном из полюсов формировались примордии семядолей, на другом – зародышевый корешок и хорошо развитый суспензор (рисунок 3). Растения-регенеранты выращивались на безгормональной среде MS с активированным углем.
Соматический эмбриогенез из сегментов вегетативных побегов лиственницы сибирской
Влияние состава питательных сред на индукцию каллусогенеза из сегментов вегетативных побегов лиственницы сибирской. Формирование ЭСМ из сегментов вегетативных побегов начиналось на 8-12-е сут. Культивирования после переноса эксплантов с безгормональной среды, на которой они подвергались холодовой обработке (3-5 дней), на индукционную среду (? MSI или DCRI), содержащую 2,4-Д (4.42 мг/л) и 6-БАП (2 мг/л). На 14 сут. начиналось формирование эмбриогенного каллуса. При добавлении в среду ИУК (2 - 4,4 мг/л) каллусная масса формировалась лишь на 40 сут., имела низкие показатели прироста и подвергалась некрозу.
Роль генотипа растения-донора в формировании ЭМ из сегментов вегетативных побегов лиственницы сибирской. Формирование ЭМ различалось у сегментов побегов полученных с разных деревьев. Наиболее активное формирование ЭМ наблюдалось у генотипа Днпу, у которого к концу инициации (28 сут.) количество эксплантов, формирующих ЭМ, достигало 78,3%. Генотип Днп1 имел наименьший процент формирования ЭМ (7,5%). Остальные генотипы имели близкие показатели формирования ЭМ (33.8-55%).
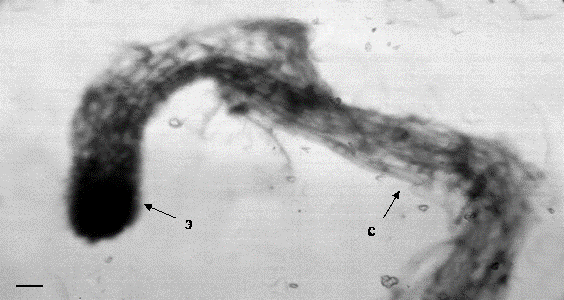
Рисунок 3 - Развитие соматических зародышей на среде MSGIV содержащей АБК: на одном из полюсов формировались примордии семядолей, на другом – зародышевый корешок и хорошо развитый суспензор (э – эмбриональная масса; с – суспензорная система). Масштаб 100 мкм
- Пролиферация и увеличение объема ЭСМ у разных деревьев также происходили по-разному. Объем ЭСМ у эксплантов генотипа Днп2 на 35 сут. достоверно превышал объем ЭСМ у эксплантов других генотипов (рисунок 4). Различия в способности формировать каллус у эксплантов с пораженных и устойчивых к почковой галлице генотипов лиственницы сибирской оказались не достоверными.
Цитологическая характеристика формирования каллуса из сегментов вегетативных побегов лиственницы сибирской. ЭМ, полученная из сегментов вегетативных побегов представляла собой отдельные клеточные скопления (число клеточных конгломератов достигало 1000,0 ± 24,3 шт. на 1 см3). Через 20 сут. культивирования в ЭСМ были обнаружены зародышеподобные структуры (рисунок 5). Полученные эмбриоиды обнаруживали строение, характерное для зиготических и соматических зародышей хвойных растений на стадии проэмбриогенеза. Андроклинные культуры лиственницы сибирской.
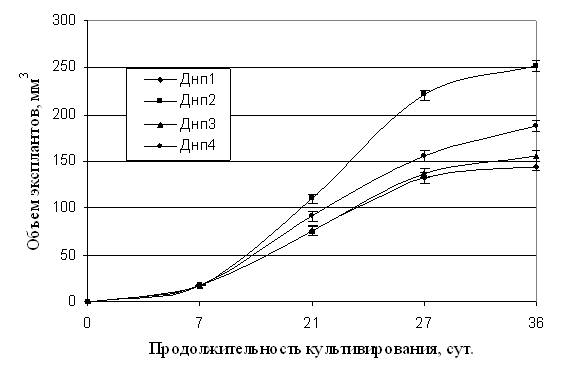
Рисунок 4 - Различие в объеме ЭМ, полученной из сегментов вегетативных побегов различных
генотипов лиственницы сибирской
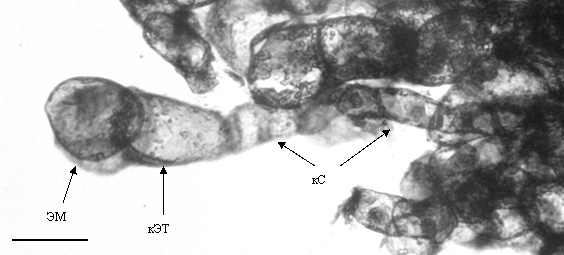
Рисунок 5 - Зародышеподобные структуры в эмбриональной массе, полученной из сегментов
вегетативных лиственницы сибирской: ЭМ - клетки эмбриональной массы, кЭТ - клетки типа
эмбриональных трубок; кС - клетки суспензорного типа. Масштаб 50 мкм
Влияние стадии развития эксплантов на индукцию андроклинных культур лиственницы сибирской. Использование для андроклинии пыльцевых зерен лиственницы сибирской оказалось нецелесообразным, поскольку даже при их искусственной обработке низкими положительными температурами переход на спорофитный путь развития не происходил. Наиболее активно формирование андроклинного каллуса происходило при культивировании микроспорангиев весной (апрель) на стадии формирования микроспор (63,2 % и 85 % на средах MSа1 и MSа2, соответственно).
Влияние состава питательных сред и условий культивирования на индукцию андроклинных культур. Состав питательной среды оказал заметное влияние на индукцию андроклинии у лиственницы сибирской. Индукция андроклинии активно шла на средах K99, MS и ? MS.
Прирост андроклинного каллуса зависел от содержания NH4NO3 в среде. На среде MSN1 средний объем эксплантов через 1 мес. культивирования составил 99,8 ± 7,4 мм3. На средах MSN2, MSN3 и MSN4 показатели объема эксплантов были близки и варьировали от 73,6 ± 7,8 до 78,3 ± 5,1 мм3. Гормональный состав сред также оказывал достоверное влияние на процессы андроклинии. Культивирование микростробилов на среде, содержащей только ауксин (? MSa2), вызывало активное разрастание микроспорофиллов у 85 % эксплантов и прямую андроклинию (т.е. формирование эмбриоидов непосредственно из микроспор). На средах, содержащих ауксины и цитокинины, происходило активное формирование андроклинного каллуса (31,6 %). Его объем на среде ? MSа1 в течение 2-х месяцев достигал 422,4 ± 63,7 мм3 по сравнению с 116,9 ± 23,9 мм3 на среде ? MSа2, содержащей только ауксин. Действие низких концентраций ИУК (0,4-1 мг/л) было подобным действию 2,4-Д.
Влияние генотипа растения-донора на формирование андроклинных культур лиственницы сибирской. На средах К99(II), MSа1, ?MSа1 обнаруживались достоверные различия в способности генотипов формировать андроклинный каллус. При культивировании микростробилов на среде MSа1 генотип Днп4 имел наибольшие показатели прироста каллусной ткани.
На среде К99(II) андроклинный каллус наиболее активно формировался из эксплантов генотипов, не пораженных галлицей Днп1 и Днп2, и его объем на 65 сут. культивирования достигал 1808,6 ± 42,8 мм3 и 1639,1 ± 53,4 мм3, соответственно. Наименьший прирост каллуса показал генотип Дп-1, объем которого достигал 672,6 ± 59,0 мм3. На среде ? MS1 генотип Днпу имел наибольший прирост андроклинного каллуса на протяжении всего срока культивирования и на 65 сут. культивирования составил 610,4 ± 35,9 мм3. Остальные генотипы имели близкие показатели прироста каллуса, которые варьировали от 332,1 ± 22,5 мм3 до 395,6 ± 47,5 мм3.
Достоверных различий в способности эксплантов с пораженных и устойчивых к лиственничной почковой галлице генотипов лиственницы сибирской формировать каллус обнаружено не было.
Цитологическая характеристика андроклинии у лиственницы сибирской. Цитологический анализ выявил различия в протекании андроклинии на средах с различным содержанием гормонов. Через 2 нед. культивирования микростробилов на среде, содержащей только 2,4-Д происходило равное митотическое деление ядра микроспоры на два, выпячивание цитоплазмы, миграция одного из ядер и формирование перегородки между клетками. Далее следовал ряд делений образовавшихся клеток. При этом клетка, ядро которой оставалось на месте, давала начало эмбриоиду, а вторая, сформировавшаяся после миграции ядра, – суспензору. Полученные микроспориальные зародыши лиственницы сибирской морфологически были схожи с зиготическими зародышами покрытосеменных растений и имели менее развитую суспензорную систему, чем зиготические зародыши голосеменных.
При культивировании микростробилов на средах, содержащих ауксины и цитокинины, развитие андроклинных культур происходило двумя путями. В первом случае формирование эмбриоидов шло непосредственно из микроспоры как описано выше. Во втором случае происходило равное деление микроспоры (или ее ядра) на две, четыре, а затем и более клеток/ядер. В результате такого деления формировались многоклеточные структуры или многоядерные ценоциты, заключенные внутри оболочки микроспоры, т.о. происходило формирование каллуса. Через 2-3 нед. культивирования на поверхности андроклинного каллуса происходло образование эмбриоидов. Такие эмбриоиды имели 1-4 изодиаметрические клетки эмбрионального типа, а также 3-13 клеток суспензорного типа, выполняющих, вероятно, гаусториальную функцию.
Таким образом, проведенные эксперименты по микроклональному размножению у лиственницы сибирской показали высокую способность ее диплоидных (соматических) и гаплоидных клеток (микроспор) к дедифференциации, формированию эмбриогенного каллуса, соматических зародышей и эмбриоидов в культуре in vitro.
Соматический эмбриогенез из зиготических зародышей сосны сибирской (кедра сибирского) PinussibiricaDuTour.
Влияние стадии развития экспланта на индукцию соматического эмбриогенеза сосны сибирской. Культивирование мегагаметофитов сосны сибирской на стадии оплодотворения, проэмбио и кливажа (среда MS c 2,4-Д 0.5-2.0 мг/л и БАП 0.5-1.0 мг/л) показало, что на 12-15 сут. культивирования на микрокопиллярном конце мегагаметофита происходило формирование каллусной массы. В течение 3-5 нед. происходил активный рост каллуса – первоначальная масса экспланта увеличилась в 4-8 раз. Цитологический анализ показал, что клетки, составляющие каллус, были однородными, без всяких признаков дифференциации. При введении в культуру незрелых изолированных зародышей на глобулярной стадии развития наблюдалось образование эмбриогенного каллуса (ЭМ) только в 7-10% случаев. Наиболее активное формирование ЭМ происходило из зиготических зародышей на предсемядольной и более поздних стадиях развития, когда его длина составляла 3.9 - 4.7 мм, т.е. зародыш занимал ? длины коррозийной полости (конец июля - начало августа). Культивирование гибридных недоразвитых зародышей (клон № 22хА на среде 1/2МS привело к завершению эмбриогенеза в течение 2 мес. и образованию проростков.
Влияние состава питательной среды на инициацию, пролиферацию, формирование соматических зародышей сосны сибирской. Морфологический отклик эксплантов, введенных в культуру, был уже заметен через 4-8 сут., который выражался в формировании эмбриогенного каллуса по всей длине зародыша. Инициация ЭМ активно шла на средах МS, 1/2 LV и МSG с явным преимуществом на среде ? LV. На данной среде на 30 сут. инициации объем эмбриогенного каллуса составил 1180 мм3, на средах MS и MSG составил 780 и 610 мм3, соответственно.
Полученная ЭМ в течение 7 мес. (сентябрь-март) поддерживалась на пролиферационных средах (MS, ? LV, MSG) без потери пролиферационной активности. На протяжении всего срока культивирования происходил интенсивный прирост ЭМ, объем которой за 3-4 мес. составил 14000 – 20000 мм3. В ЭСМ шло интенсивное образование соматических зародышей.
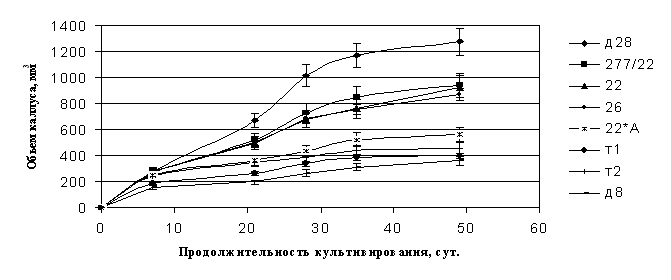
Влияние генотипа растения-донора на проли-ферацию соматического эмбриогенеза сосны сибирской. Наблюдения за динамикой роста эмбриогенного каллуса на среде MS показали, что процессы инициации и пролиферации каллуса у разных генотипов идут неодинаково. Прежде всего выделилось 3 дерева, произрастающих в естественном древостое Западного Саяна (№№ 1т. 2т. и 8), у которых за 30 сут. инициации объем эмбриогенного каллуса не превышал 400 мм3, т.е. составил в 2-3 раза меньшую величину по сравнению с остальными опытными деревьями. Пролиферация каллуса у этих деревьев шла еще более медленным темпом. Эти данные свидетельствуют о том, что указанные деревья не способны формировать эмбриогенный каллус и в дальнейшем соматические зародыши. Остальные 7 опытных деревьев формировали эмбриогенный каллус с разной степенью активности. Через 30 сут. культивирования (конец инициации) объем эмбриогенного каллуса превышал1100 мм3 (клон 28). Высокой эмбриогенной активностью обладали дерево № 277/22 и клон, полученный от этого дерева (№ 22), и клон дерева № 26. Образование ЭМ клона 22х1А (клон дерева 277/22, опыленного пыльцой гетерозисного дерева 1А с однолетним генеративным циклом) шло менее активно. ЭМ каллус у данного варианта составил 420 мм3. При пересадке на среду MS с уменьшенным вдвое содержанием фитогормонов процесс пролиферации эксплантов указанных деревьев шел также быстрым темпом. Интенсивность динамики роста эмбриогенного каллуса у всех изучаемых деревьев сосны сибирской сохранялась (рисунок 6). Через 50 сут. культивирования пролиферирующие эмбриогенные каллусы распадались на ряд отдельных кусочков, которые продолжали активно расти при последую-
щих пересадках.
Таким образом, обнаруживается значительное влияние генотипа донорского дерева кедра сибирского на рост эмбриогенного каллуса и образование в нем соматических зародышей.
Влияние стрессовой обработки эксплантов сосны сибирской на рост эмбриогенного каллуса сосны сибирской. Проведенные исследования показали, что выдерживание семян кедра сибирского в условиях холодильной камеры при температуре 4оС в течение 2-4-х мес. привело к активному росту эмбриогенного каллуса на пролиферационной среде. На средах МS и ? LV объем эмбриональной массы у эксплантов, подвергнутых обработке холодом в течение 2-4, составил к концу пролиферации составил 730-800 мм3. Принимая во внимание, что для прорастания семена кедра сибирского требуют стратификации (температура +4оС), не исключено, что обработка эксплантов пониженными температурами стимулирует рост эмбриогенного каллуса.
Вызревание соматических зародышей сосны сибирской. Через 2-3 мес. культуры поэтапно переводили из пролиферирующей среды на безгормональную среду с добавлением активированного угля (1 неделя), а затем помещали на среду MS, содержащую АБК (5 - 15 мг/л). Пробирки выставляли на свет и проводились наблюдения за появлением соматических зародышей. Через 2 нед. культивирования в данной среде отмечали появление зародышей с семядолями на поверхности эмбриогенного каллуса. На одном каллусе длиной 1.5 – 2 см образовывалось до 10-20 соматических зародышей. Через 1-2 мес. пребывания в данной среде соматические зародыши переносились в среду для проращивания. Данный эксперимент продолжается.
Получение ЭСМ и соматических зародышей
Рисунок 6 - Интенсивность динамики роста эмбриогенного каллуса у всех изучаемых деревьев сосны сибирской
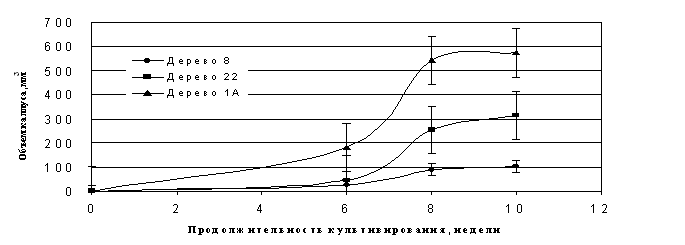
Рисунок 7 - Динамика роста эмбриогенного каллуса, полученного из сегментов вегетативных побегов различных генотипов кедра сибирского
из сегментов вегетативных побегов сосны сибирской.Культивирование сегментов побегов сосны сибирской, собранных с деревьев 3-х клонов (№№ 22,26 и 1А – клон дерева с однолетним циклом развития женских шишек), проводилось на среде ? MS c глютамином. В течение первых 3 сут. культуры выдерживались в условиях холодильной камеры (температура +2- +4оС), а затем помещались в термостат (температура 25оС). На 8-10 сут. культивирования на поверхности срезов вегетативных побегов отмечено появление ЭСМ. При дальнейшем культивировании наблюдалось увеличение объема ЭМ. Наибольший прирост эмбриогенной массы отмечен у клона, полученного от дерева №1А, с однолетним циклом развития женской шишки – 590 мм3 (рисунок 7).
Цитологический анализ ЭСМ, полученной из сегментов вегетативных побегов сосны сибирской после 6 нед. культивирования, показал, что она состоит из двух типов клеток: эмбриональных трубок (длина 158 мкм, ширина 54 мкм) и мелких изодиаметрических клеток средний диаметр (43 мкм). Кроме того, были обнаружены глобулы соматических зародышей.
Индукция андроклинии у сосны сибирской
Образцы микростробилов сосны сибирской подвергали холодовой обработке (+2-+40С). Для культивирования использовали среду MS с добавлением 2,4-D в концентрации 0,2-0,5 мг/л.
Исследования показали, что в условиях культуры invitro уже через 3-4 сут. покровы микростробилов разрывались и пыльца попадала на поверхность среды. В течение 2-3 недель пыльцевые зерна прорастали и формировали трубки, которые сильно разрастались. На среде, содержащей 0,2 мг/л 2,4D, ядро вегетативной клетки спускалось в трубку. Генеративная клетка оставалась внутри оболочки гаметофита и делилась, образуя через месяц культивирования кластеры и глобулярные структуры эмбриоидов.
Таким образом, у представителей сибирских видов хвойных путем подбора состава питиательных сред на тканевом и клеточном уровне были получены морфогенные каллусы различного генетического и онтогенетического происхождения, способные продуцировать эмбрионально суспензорную массу из которой формировались соматические зародыши.
Выявлены генотипы донорских растений лиственницы сибирской и сосны сибирской, способные давать чистые эмбриогенные линии и соматические зародыши.
Работа выполнена при поддержке гранта РФФИ № 06-04-08040-офи_а, гранта РФФИ-ККФН «Енисей» № 04-040-96810.
Библиографический список
- Паушева, З.П. Практикум по цитологии растений [текст]/ З.П. Паушева .– М.: Колос, 1980. – 340 с.
- Klimaszewska, K. Conifer somatic embryogenesis: I. Development / K.Klimaszewska, D.R. Cyr // Dendrobiology. – 2002. – V. 48. – P. 31-39.
- Lelu, M.A. Somatic embryogenesis from immature and mature zygotic embryos and from cotyledons and needles of somatic plantlets of Larix /Lelu M.A., K.Klimaszewska, P.J. Charest // Can. J. For. Res. – 1994. – V. 24. № 1. – P. 100-106.
- Malabadi,R. Somatic embryogenesis from vegetative shoot apices; of mature trees of Pinus patula / R. B. Malabadi, J. Van Staden // Tree Physiology. – 2005. – V. 25. – P. 11-16.
- Deutsch, F. Stable haploid poplar callus lines from immature pollen culture / F. Deutsch, J. Kumlehn, B. Zeigenhagen, M. Fladung Physiologia plantarum. – 2004. – V. 120. – P. 613-622.
- Murashige, T. .A revised medium for rapid growth and bioassays with tobacco tissue cultures / T. Murashige, F.Skoog // Physiol. Plant. – 1962. – V. 15. – №4. – P. 473-497.
- Becwar, M.R., Nagmani R., Wann S.R. Initiation of embryogenic cultures and somatic embryo development in loblolly pine (Pinus taeda) / M.R.Becwar, R.Nagmani, S.R. Wann // Can J For Res. – 1990. – V. 20. – P. 810-817.
- Plant cell, tissue and organ culture: fundamental methods / Eds. O.L. Gamborg, G.C. Phillips. – Berlin: Springer-Velag, 1995. – 358 p.
|




