|
"Хвойные бореальной зоны" 2003г.,№1, с.
ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ КОРЫ ЛИСТВЕННИЦЫ СИБИРСКОЙ
Иванова С.З, Федорова Т.Е., Иванова Н.В., Остроухова Л.А., Малков Ю.А., Бабкин В.А.
Иркутский институт химии им. А.Е. Фаворского СО РАН, Россия, г. Иркутск
Работа выполнена при финансовой поддержке Минпромнауки России в рамках подпрограммы «Комплексное использование древесного сырья»
Исследован состав фенольных соединений коры лиственницы сибирской (Larix sibirica Ledeb.). Показано, что в коре присутствуют широкий набор фенолокислот и их эфиров и представители практически всех классов флавоноидов, начиная от флаванона нарингенина до бифлавоноидов, проантоцианидинов и конденсированных таннинов. Отмечено, что фенольные соединения можно отнести к двум основным группам, исходя из типа гидроксилирования ароматического кольца у фенолокислот и кольца В у флавоноидов - п-гидроксифенильному (монозамешенному) и пирокатехиновому (дизамещенному). Установлено, что бифлавоноиды спиро-типа присутствуют в олиго- и полимерных флавоноидных соединениях, очевидно, как структурные звенья.
The phenolic compounds of Larix sibirica Ledeb. bark are investigated. It is shown, that there are representatives phenolic acids in the bark with esters and practically all flavonoids classes, beginning from flavanone naringenin up to biflavonoids, proanthocyanidins and condensed tannins. It is marked, that the phenolic compounds can be attributed to two basic groups, proceeding from a type of hydroxylation of the phenolic acids aromatic ring and ring В of the flavonoids - p-hydroxyphenyl (monoreplaced) and catechol (direplaced). It is established, that biflavonoids of a spiro-type are present in oligo- and polymeric flavonoid compounds, obviously as structural parts.
Фенольные соединения - одна из самых многочисленных и широко распространенных групп природных соединений, привлекающих внимание, особенно в последние годы, благодаря необычайно широкому спектру их биологической активности.
Кора лиственницы является неиспользуемым отходом деревоперерабатывающих предприятий, но может быть богатым источником биологически активных фенольных соединений, содержание которых достигает 15-18% от веса сухой коры.
Этилаиетатный экстракт коры лиственницы сибирской (8 г), полученный по схеме, описанной в работе [4]. фракционировался методом флэшхроматографии с использованием в качестве сорбента силикагеля, в качестве элюента - смеси хлороформ-метанол с увеличением доли последнего. При этом были получены следующие фракции, содержащие: I фенолокислоты и их эфиры (0-4% СН3ОН в СНС13, 0,99 г. ); И - мономерные флавоноиды (6
10% СН3ОН в СНСЬ, 1,2 г); III спиробифлавоноиды и проантоцианидины (1520% СН3ОН в СНСЬ, 2,9 г), IV - олигомеры (30% СН3ОН в СНС13, 1,7 г), V - полимеры (100% СН3ОН в СНС13, 1,02 г). Рехроматографией этих фракций выделялись индивидуальные соединения или субстанции, обогащенные определенными компонентами, которые анализировались
методами ТСХ и ВЭЖХ. Методы выделения и идентификации фенолокислот и их эфиров описаны в работах [4, 12].
Анализ флавоноидных соединений методом ТСХ осуществляли на пластинках Silufol в системах: бензол - ацетон (4:1; 2:1, 1:1), гексан этилацетат (3:1; 3:2, 1:1; 2:3), проявитель диазотированная сульфаниловая кислота, А1С13, раствор ванилина в конц. HCI. ВЭЖХ-анализ флавоноидных фракций проводили на приборе Милихром-4 с УФ-детектором при следующих условиях:
Колонка - 64 мм х 2,0 мм
Сорбент -СепаронС|8
Аналитическая длина волны - 280 нм
Подвижная фаза - ацетонитрил в 2%-ной уксусной кислоте (градиент от 3:7 до 1:1, об.) Скорость потока подвижной фазы - 100 мкл/мин
Идентификацию известных соединений осуществляли хроматографическими методами сравнением с аутентичными образцами. Неизвестные соединения выделяли либо в нативном (фенольном) виде, либо в виде ацетатов. Ацетилирование фракций и соединений проводили как описано в [5]. Установление строения соединений осуществляли с использованием методов УФ-, ИК-и ЯМРспектроскопии.
УФ-спектры растворов соединений в метаноле получены на приборе Specord UV VIS. ИК спектры снимали на приборе Specord 75IR в таблетке с КВг (2,5 мг/ЗООмг КВг).
Спектры ЯМР 'Н и |3С образцов регистрировали на приборе Bruker DPX 400 с рабочей частотой 400 и 100 МГц, соответственно, в CDC13, (CD3)CO и в CD3OD. Отнесение сигналов в спектрах ЯМР 'Н и '"С осуществлено с использованием двумерной спектроскопии: методик HMQC, HMBC, COSY, NOESY и многоимпульсной последовательности JMOD.
Фенольные соединения коры лиственницы, идентифицированные нами и обнаруженные ранее другими исследователями [4, 7-16], рассматриваются, начиная от фенолкарбоновых и оксикоричных кислот до конденсированных таннинов.
Фенолокислоты
Среди растительных фенольных соединений оксикоричные кислоты занимают особое положение. Они широко распространены в растениях и являются биогенетическими предшественниками большинства других фенольных соединений [3]. В коре хвойных растений фенолкарбоновые и оксикоричные кислоты входят в состав фенольного воска и
соон
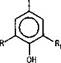
представлены как в свободном состоянии, так и в виде сложных эфиров с алифатическими спиртами. [2,8,12,13,15 ].
В этилацетатном экстракте коры лиственницы сибирской нами было установлено наличие следующих кислот: фенолкарбоновых и-оксибензойной, протокатеховой, ванилиновой кислот и, впервые, сиреневой кислоты, а также оксикоричных - и-кумаровой (цис-, транс-формы), феруловой (цис-, транс-формы) и кофейной кислот [4].
ChH=CH—СООН
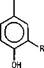
R=Ri=H - и-оксибензойная R=H - я-кумаровая
R =H, R,= ОН протокатеховая R=OH- кофейная
R=H, R|=OCH3- ванилиновая R=OCH3 - феруловая
R= Ri= ОСН3 -сиреневая
Сложные эфиры фенолокислот лиственницы сибирской наряду с фракцией
В литературе имеются сообщения о алкилферулатов была выделена фракция выделении из коры лиственницы сибирской алкилкумаратов. Комплексом физико-химических алкилферулатов [7, 15]. Спиртовая часть эфиров методов анализа (УФ-, ИК-спектроскопии, представлена рядом высших «-алифатических спектроскопии ЯМР |3С, хроматомассспиртов С2 0 -С24, среди которых доминируют спектрометрии) установлено, что в состав эйкозанол и докозанол. сложных эфиров входит /яранс-я-кумаровая
Нами при изучении этилацетатного кислота и высшие н-алифатические спирты с экстракта коры доминирующим содержанием н-эйкозанола [12].
-О — (СН2)п —СН 3

R=H, п=18 - эйкозанилкумарат R=OCH3, п=18 - эйкозанилферулат R=OCH3, n=20 - докозанилферулат
Флавоноидные соединения коры нарингенина, который считается лиственницы обсуждаются в последовательности, предшественником всех флавоноидов [3]. соответствующей их возможной биогенетической Флаваноны. В коре лиственницы
взаимосвязи, начиная от флаванона обнаружен только один представитель флаванонов - нарингенин [4].

R=H-HapHHreHHH
Флавонолы и дигидрофлавонолы. В коре идентифицирован ряд флавонолов: кемпферол, кверцетин, мирицетин,
изорамнетин, и два дигидрофлавонола дигидрокемпферол (аромадендрин)и
дигидрокверцетин (таксифолин) [4], причем доминирующим является дигидрокверцетин. Кроме этого, в коре обнаружены три гликозида кверцетина: 3-а- L-рамнофуранозид, 3-а- L
арабинофуранозид,, З-се-Ь-арабинопиранозид [8].
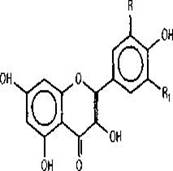
Интересно, что в коре лиственницы флавонолы, имеющие галлоильный (трижды замещенный) тип замещения в кольце В, представлены только мирицетином, тогда как г хвое были обнаружены моно -и диметоксилированные производные мирицетина ларицитрин и сирингетин, соответственно [11].
Из метоксилированных флавонолов в коре идентифицирован представитель кверцетинового ряда - изорамнетин [4].
Флаван-3-олы. Об обнаружении флаван-3олов в коре лиственницы сообщается в ряде работ [8, 9, 13]. Идентифицированы (-)эпиафцелехин, (-)-эпикатехин, (+)-катехин [8, 9] и (+)-галлокатехин, 7-0-|3-глюкопиранозид (
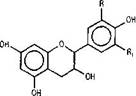
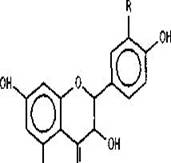
эпикатехина, 7-О-Р-глюкопиранозид (+)-катехина и рамнозид (+)-катехина [13]. Следует отметить, что галлоильный тип
R=R,=H - (-)эпиафцелехин R=OH, R,= H(+)-катехин, (-)-эпикатехин R=R,=OH - (+)галлокатехин
собой пеларгонидин, ацилированный двумя ароматическими кислотами: и-гидроксибензойной по положению 3 гетерокольца С и феруловой кислотой по положению 7 кольца А.
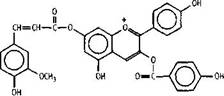
Листвинидин
нового бифлавоноидного соединения лиственола Бифлавоноиды и процианидины. [Ю]. Структура этого соединения была В 1973 году было опубликовано сообщение определена более корректно в 1985 году Шеном
об идентификации в коре лиственницы сибирской 3. и сотр, выделившими этот бифлавоноид, названный авторами лариксинолом, из коры
лиственницы Гмелина [18,19.]. Использование авторами более совершенных методов анализа позволило установить, что данное соединение является представителем нового класса флавоноидных соединений спиробифлавоноидов, причем спирановая система
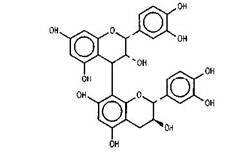
Димерные диастереизомерные процианидины В-1, В-2, В-3, В-4, образующиеся на основе (-)-эпикатехина и (+)-катехина, были обнаружены нами во фракциях, содержащих
Олигомеры и конденсированные таннины
Анализ олигомерных и полимерных фракций этилацетатного экстракта коры лиственницы сибирской (фракции IV и V, соответственно) методами ИК спектроскопии и спектроскопии ЯМР 13С показал наличие диагностических сигналов спиробифлавоноидов с у-бутиролактонным циклом в спирановой системе (vc=o = 1793,5 и 1789,9 см"1 в ИК спектрах и сигналы с химическими сдвигами (ХС) 61.6, 91,7 и 176.9 м.д. в спектрах ЯМР |3С) [18-20], которые, вероятно, также входят в состав этих соединений.
Данные метода количественной спектроскопии ЯМР |3С позволили оценить стереохимию заместителей в цикле С мономерных единиц олигомерных и полимерных фракций и определить соотношение 2,3-цис-и 2,3-транс-изомеров [1, 6]. Было показано, что в состав фракции IV входят блоки как с 2,3-транс(ХС С-2 82.1 м.д.), так и 2,3-цис- стереохимией (ХС С-2 79.4 м.д.). Для установления количественного соотношения 2,3- транс-и 2,3цис-блоков использовали измерение интегральных интенсивностей сигналов с указанными ХС. Это соотношение для фракции IV составило 0,7:1.
представлена двумя бензофурановыми циклами, один из которых является у-лактонным.
Интересно, что из семян винограда Vitis amurensis Rupr. [20] выделен спиробифлавоноид витизинол, являющийся аналогом лариксинола., отличающийся только степенью гидроксилирования колец В.
R=H -лариксинол
11=ОН-витизинол
спиробифлавоноиды, но так как они уже были описаны ранее Шеном и соавт. [19], мы не выделяли их в индивидуальном виде.
Процианидин В-1
Анализ ХС сигналов в области атомов углерода кольца В мономерных единиц фракции IV показал, что олигомерная фракция состоит из процианидиновых (PC) (пирокатехиновый тип замещения кольца В) и пропеларгонидиновых (РР) модулей (п-гидроксифенильный тип замещения кольца В). В работе [17] для количественных измерений соотношения процианидиновых (PC) и продельфинидиновых модулей (PD) в проантоцианидинах были использованы интегральные интенсивности сигналов С-3' и С-4' PC-модулей (ХС 145 м.д.) и С-3' и С-5' PD-модулей (ХС 146 м.д.). Однако в нашем случае сигнал С-4' РР-модулей не является показательным (ХС 157 м.д.), так как в этой области спектра проявляются также сигналы атомов углерода Сар-0 колец А мономерных блоков.
Поэтому для оценки РР:РС соотношения были использованы сигналы атомов углерода при
128.5 м.д. (С-2' и С-6' РР-модулей) и при 119.6 м.д. (С-6' PC модулей). Интегрирование этих сигналов показало, что соотношение флавоноидных модулей с п-гидроксифенильным типом замещения в кольце В к модулям пирокатехинового типа равно 3:1. Отсутствие сигналов четвертичных атомов углерода в области 128.5 м.д. спектра ЯМР 13С фракции IV было подтверждено с помощью методики JMOD
Следовательно, можно предположить, что олигомерные и полимерные флавоноиды коры лиственницы сибирской являются продуктом конденсации димеров спиро-типа (лариксинол), флаван-3-олов и процианидинов(В1-В4).
Таким образом, фенольные соединения коры лиственницы сибирской можно отнести к двум основным группам, исходя из типа гидроксилирования ароматического кольца у фенолокислот и кольца В у флавоноидов - пгидроксифенильному (монозамещенному) и пирокатехиновому (дизамещенному).
Выводы
Исследован состав фенольных соединений, экстрагируемых этилацетатом из коры лиственницы сибирской (Larix sibirica Ledeb.). Показано, что в коре присутствует широкий набор фенолокислот и их эфиров, а также
представители практически всех классов флавоноидов, начиная от флаванона нарингенина до бифлавоноидов, проантоцианидинов и конденсированных таннинов. Отмечено, что фенольные соединения можно отнести к двум основным группам, соответствующих типу гидроксилирования ароматического кольца у фенолокислот и кольца В у флавоноидов - пгидроксифенильному (монозамещенному) и пирокатехиновому (дизамещенному). Показано, что олигомерная фракция состоит из процианидиновых (PC) (пирокатехиновый тип замещения кольца В) и пропеларгонидиновых (РР) модулей (п-гидроксифенильный тип замещения кольца В). Установлено, что бифлавоноиды спиро-типа присутствуют в олигои полимерных флавоноидных соединениях, очевидно, как структурные звенья. Проведена оценка стереохимии заместителей в цикле С мономерных единиц олигомерных и полимерных фракций и определено соотношение 2,3 - транс-и 2,3 - цис-изомеров.
Наличие в коре лиственницы сибирской такого большого набора биологически активных фенольных соединений дает основание считать кору ценным сырьем для получения практически значимых продуктов различного назначения: для медицины, пищевой, парфюмерно-косметической промышленности и др.
Библиографический список
- Вдовин А.Д., Кулиев З.А., Абдуллаев Н.Д. Спектроскопия ЯМР 'Н и ,3С в изучении флаван-3-олов, проантоцианидинов и их производных. III. Спектроскопия ядерного магнитного резонанса 13С флаван-3-олов и проантоцианидинов // Химия природн. соед. 1997.-№4. С. 545-568.
- Громова А.С, Луцкий В.И., Тюкавкина Н.А. Фенолокислоты и их производные из коры некоторых видов пихты, ели и сосны // Химия природн. соед. - 1978. - № 4. - С. 99-102.
- Запрометов М.Н. Фенольные соединения. -М.: Наука, 1993.-272 с.
Комплекс мономерных фенольных соединений коры лиственницы / Н.В. Иванова, Л.А. Остроухова, В.А. Бабкин, С.З. Иванова, О.А. Попова // Химия растительного сырья. - 1999. - № 4.-С. 5-7.
- Полимер дигидрокверцетина из древесины лиственницы / С.З. Иванова, Т.Е. Федорова, Л.А. Остроухова, СВ. Федоров, Н.А. Онучина, В.А. Бабкин // Химия растительного сырья. - 2001. - № 4. - С. 21-24
- Калабин Г.А., Каницкая Л.В., Кушнарев Д.Ф. Количественная спектроскопия ЯМР природного органического сырья и продуктов его переработки. - М.: Химия, 2000. - 408 с.
- Лаптева К.И., Тюкавкина Н.А., Остроухова Л.А. Некоторые экстрактивные фенольные вещества коры лиственницы // Изв. СО АН СССР, сер. хим. - 1974. -Вып. 4. - С. 163.
- Лейман З.А. Изучение полифенолов коры лиственницы сибирской: Автореф. канд. дис. Алма-Ата, 1974.
- Пашинина Л.Т., Чумбалов Т.К., Лейман З.А. Катехины коры Larix sibirica // Химия природн. соед. - 1970. - № 4. - С. 478.
- Пашинина Л.Т., Чумбалов Т.К., Лейман З.А. Лиственол - новый флавоноид коры Larix sibirica //Химия природн. соед. - 1973. - № 4. 5. С. 623-629.
- Тюкавкина Н.А., Лаптева К.И., Медведева С.А. Фенольные экстрактивные вещества рода Larix // Химия древесины. - 1973. № 13.-С. 3-17.
- Алкилкумараты коры лиственницы сибирской и даурской / Т.Е. Федорова, С.З. Иванова, Н.В. Иванова, Л.А. Остроухова, СВ. Федоров, В.А. Бабкин // Химия растительного сырья. -2002.- №2.-С . 89-91.
- Черняева Г.Н., Пермякова Г.В. Фенолкарбоновые кислоты и мономерные флаваны коры Larix sibirica Ledeb. // Растительные ресурсы. - 2000. - Т. 36, № 3. - С. 47-51.
- Чумбалов Т.К., Пашинина Л.Т. Флавонолы коры Larix sibirica // Химия природн. соед.- 1967.-№3,-С. 216.
- Чумбалов Т.К., Пашинина Л.Т., Лейман З.А. Полифенолы коры Larix sibirica // Химия природн. соед. - 1973. - № 2. - С. 284-285.
- Чумбалов Т.К., Пашинина Л.Т., Лейман З.А Флавоноиды коры Larix sibirica // Химия природн. соед. - 1970. - № 6. - С. 763-764.
- Polymeric proanthocyanidins. Stereochemistry, structural units, and molecular weight / Z. Czochanska, L. Y. Foo, R. H. Newman, L. J. Porter // J. Chem. Soc. Perkin Trans I. - 1980. № 10.-P. 2278-2286.
- A Novel Spiro-Biflavonoid from Larix gmelini / Z. Shen, CP. Falshaw, E. Haslam, M.J. Begley // J. Chem. Soc. Chem. Commun. - 1985. - N 16.-P. 1135-1137.
- Procyanidins and Polyphenols of Larix gmelini Bark / Z. Shen, E. Haslam, CP. Falshaw, M.J Begley // Phytochemistry. - 1986. -V.25. - P. Chen // Phytochemistry. - 2000. - V. 53. - P. 10972629-2635. 1102.
- Procyanidins from the seeds of Vitis amurensis / J.-N. Wang, Y. Hano, T. Nomura, Y.-J.
|




